TRABAJOS ORIGINALES
Inmunogenicidad y Eficacia de una Nueva Vacuna de una Recombinante de Hepatitis b en el Perú
Adelina Lozano M. *+; Jorge Caycho O. **; Antonio Antunez de Mayolo ***; Dolly Vera**; David Posadas R. **.
* Médico Asistente del Servicio de Gastroenterología del Hospital Arzobispo Loayza.
+ Director Médico de Biotoscana Farma S.A.
** Departamento Médico de SEDAPAL
*** Médico Inmunólogo Universidad Peruana Cayetano Heredia.
RESUMEN
Aproximadamente 350 millones de personas están infectadas con
hepatitis B en el mundo. El Perú es uno de los países con alta
prevalencia de Hepatitis B en América Latina. La hepatitis B causa
hepatitis crónica, cirrosis y carcinoma hepatocelular. La vacunación es
el único método que ha demostrado ser eficaz en el control de la
enfermedad.
Este es un estudio prospectivo, aleatorio,
conducido con el propósito de evaluar la inmunogenicidad y seguridad de
la vacuna Hepavax-Gene, una nueva vacuna de DNA recombinante, en
personas sanas mayores de 10 años de edad en el Perú.
La vacuna fue administrada vía intramuscular en el músculo deltoides en
dosis de 10 microgramos a personas de 10 a 19 años y de 20 microgramos a
mayores de 19 años, con el esquema de vacunación de tres dosis: el día
0, a los 30 días y a los 180 días. 67 personas terminaron el estudio de
un total de 188 personas admitidas inicialmente.
La
inmunogenicidad fue satisfactoria: 100% de los participantes en el Grupo
A (10 a 19 años) y 100% de los participantes del Grupo B (mayores de 19
años). Con una media aritmética de 28,583.92 mIU/mL y una media
geométrica de 5,754.32 mIU/mL en el Grupo A. y con una media aritmética
de 8,708.3 mIU/mL 2 y una media geométrica de 2,179.32 mIU/mL en el
Grupo B. Los eventos adversos fueron del 4.69%. Ninguno fue severo.
La vacuna de DNA recombinante derivada de H. Polymorpha es inmunogénica
y segura en peruanos sanos mayores de 10 años aplicada en tres dosis a
los días 0, 30 y 180.
Palabras claves: Hepatitis B - vacuna, Títulos de anticuerpos, Hansenula Polymorpha
SUMMARY
Approximately 350 million persons are infected with Hepatitis B virus
around the world. Peru is one of the countries with high prevalence of
Hepatitis B in Latin America and this disease is an important cause of
chronic hepatitis, cirrhosis, and hepatocellular carcinoma in our
country. Vaccination is the only method that has proved to be effective
in the control of this disease.
This is a prospective,
randomized study performed with the purpose of evaluating immunogenicity
and efficacy of the Hapavax-Gene vaccine in Peru, a new recombinant DNA
vaccine, in healthy persons over 10 years of age. The vaccine was
applied intramuscularly, on the deltoid muscle, in 10 microgram doses,
to persons between 10 and 19 years of age and 20 microgram doses in
persons over 19, using the three doses vaccination scheme: day 0, after
30 days and after 180 days. Out of a total of 188 persons initially
admitted for this test, 67 persons completed the study.
Immunogenicity was satisfactory: 100% of the participants of Group A
(10 to 19 years of age) and 100% of the participants of Group B (over
19). With an arithmetical mean of 28,583.92 mlU/mL and a geometrical
mean of 5,754.32 mlU/mL in Group A and an arithmetical mean of 8,708.3
mlU/mL 2 and a geometrical mean of 2,179.32 mlU/mL in Group B. Adverse
events accounted for 4.69%, none of which was severe.
The recombinant DNA vaccine derived from H. Polymorpha applied in three
doses on day 0, after 30 days and after 180 days, is immunogenic and
safe in healthy Peruvians over 10 years of age.
Key words: Hepatitis B - vaccine, antibody titers, Hansenula Polymorpha
INTRODUCCIÓN
Aproximadamente 350 millones de personas están infectadas con hepatitis
B en el mundo. El Perú es uno de los países de
alta prevalencia de Hepatitis B en América Latina y esta enfermedad
es una causa importante de hepatitis crónica, cirrosis y carcinoma
hepatocelular en nuestro país.(1-2) En tribus del Nor- oriente peruano,
(Jivaroes) la prevalencia de hepatitis B es del 94% (3) y la
morbi-mortalidad por el virus en áreas de alta prevalencia como Abancay y
Huanta alcanza tasas muy altas (4-5).
El tratamiento
de esta enfermedad genera costos elevados, en los Estados Unidos, por
ejemplo, los costos médicos directos relacionados a la Hepatitis B
exceden a un millón de dólares por día.
La hepatitis B
es una enfermedad prevenible por vacunas; la vacunación es el único
método que ha demostrado ser eficaz en el control de la enfermedad. Las
primeras vacunas disponibles fueron derivadas de plasma, luego se
introdujeron las vacunas de DNA recombinante, en Estados Unidos en 1986.
La vacuna recombinante de hepatitis B es usada a gran
escala en los programas de inmunización. De estas vacunas, la que usa
la levadura de Sacharomyces cervisiae es la más usada. En los últimos
años se desarrolló una vacuna recombinante de hepatitis B usando la
levadura Hansenula polymorpha, se establece que esta vacuna ha mejorado
la productividad y estabilidad. (6)
Este estudio fue
conducido con el propósito de evaluar la inmunogenicidad y seguridad de
la vacuna Hepavax-Gene (Biotoscana Farma), una nueva vacuna de DNA
recombinante, en personas sanas mayores de 10 años de edad en Perú.
MATERIAL Y MÉTODOS
El presente es un estudio, prospectivo aleatorio, para investigar la
inmunogenicidad y seguridad de la vacuna de DNA recombinante de
Hepatitis B: Hepavax Gene en personas sanas mayores de 10 años con tres
dosis.
En Agosto del 2002 se inició el estudio en
familiares de los trabajadores de Servicio de Agua Potable y
Alcantarillado de Lima (SEDAPAL), las personas que participaron en el
estudio correspondieron a cuatro regiones diferentes de Lima: Villa el
Salvador, Tingo María, Atarjea y Comas. Se utilizó las tablas de
muestreo aleatorio para la selección de voluntarios.
Criterios de inclusión:
-No vacunación previa
- Personas mayores de 10 años.
- Personas en buen estado general.
- A todos los participantes, antes de ser admitidos en el estudio se
les tomará una muestra de sangre para determinar la presencia de Ag HBs,
Anti HBc total y Anti HBs.
- Marcadores negativos de Hepatitis B al momento de la admisión.
- Consentimiento informado firmado por los participantes o por sus padres.
Criterios de exclusión:
- Personas vacunadas previamente.
- Personas con algún marcador viral de hepatitis B positivo.
- Estado febril agudo, o enfermedad en el momento de la vacunación.
Criterios para retirar un paciente del estudio:
- Personas con efectos adversos severos a la vacuna
- Personas que no deseen continuar por razones diferentes a los efectos adversos.
- Por decisión del investigador, por incumplimiento de las normas establecidas para el desarrollo del estudio.
Se utilizó el esquema de vacunación 0-30-180 días, en los
participantes de 10 a 19 años (Grupo A) se utilizó 10 microgramos/dosis y
en los mayores de 19 años (Grupo B) se utilizó 20 microgramos/dosis.
Cada dosis fue inyectada en el deltoides vía intramuscular.
Todos los participantes del estudio firmaron una ficha de
consentimiento informado, en los menores de 19 años la ficha fue firmada
por sus padres.
Seguimiento:
Después de cada dosis los pacientes fueron controlados por teléfono
durante las primeras 48 horas e interrogados sobre la presencia de
síntomas posteriores a la vacunación, en cada una de las dosis
aplicadas, esta entrevista telefónica fue realizada personalmente por el
investigador principal según ficha de reacciones adversas que fue
entregada en el momento de la vacunación. Las reacciones fueron
clasificadas de acuerdo a su severidad en leves, moderadas o severas,
locales y sistémicas, definiendo como severa a las reacciones que
colocaron en riesgo la vida del paciente.
Entre 30 y
60 días después de la última dosis se tomó una muestra de sangre para la
determinación de los títulos de anticuerpos protectores. Se empleó para
el examen la prueba de determinación cuantitativa. La determinación
cuantitativa de Anticuerpos al Antígeno de Superficie del Virus de
Hepatitis B (Anti-HbsAg) subtipos ad y ay se realizó por la técnica de
inmunoensayo enzimático de micropartículas (MEIA) (Abbott Laboratories.
Abbott Park, IL USA) en un autoanalizador Axsym (Abbott). Para la
calibración del autoanalizador se emplearon calibradores con
concentraciones referenciados a los calibradores de Imunoglobulinas
anti-Hepatitis B de la Organización Mundial de la Salud (OMS) expresadas
en mIU/mL (1st International Reference preparation of anti-Hepatitis B
Inmunoglobulin). El valor del punto de corte Negativo (Cut off) fue
menor a 10 mIU/mL. Los sueros positivos con valores mayores a 1000
mIU/mL fueron diluidos por el autoanalizador hasta el valor de 25000
mUI/mL, aquellas muestras con valores superiores a 25000 mIU/mL fueron
adicionalmente diluidas manualmente.
La respuesta a la vacunación se clasificó según los títulos de Anti HBs en:
1.- Títulos menores de 10 UI/L Sin seroprotección.
2.- Títulos mayores de 10 UI/L Seroprotección.
RESULTADOS
Un total de 188 personas mayores de 10 años fueron admitidas al estudio, 100 del grupo A y 88 del Grupo B.
Fueron excluidas 6 personas por tener algún marcador para hepatitis B positivo.
Acudieron a recibir la segunda dosis 106 personas, y la tercera dosis
86 personas, de las cuales solamente acudieron al control para toma de
sangre y titulación de anticuerpos 67 personas.
Finalmente un total de 67 personas, 37 del grupo A y 30 del grupo B concluyeron el estudio.
GRUPO A: (10 años - 19 años)
19 personas correspondieron al sexo masculino y 18 al sexo femenino.
GRUPO B: (Mayores de 19 años)
8 personas fueron de sexo masculino y 22 personas fueron de sexo femenino.
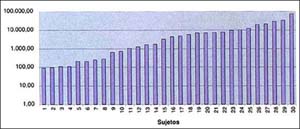
Inmunogenicidad.
Todos los voluntarios del grupo A tuvieron títulos anti Ag HBs mayor a 10 mIU/mL, indicando 100% de seroprotección
(gráfico No. 1)
36/37 lograron títulos altos mayores a 100 mIU/mL.
El título mas bajo del grupo A fue 45.90 mIU/mL y el mas alto fue
219,490 mIU/mL con una media aritmética de 28,583.92 mIU/mL y una media
geométrica de 5,754.32 mIU/mL
Todos los voluntarios del grupo B tuvieron títulos anti Ag HBs mayor a 10 mIU/mL, indicando 100% de seroprotección
(gráfico No. 2)
28/30 lograron títulos altos mayores a 100 mIU/mL.
El título mas bajo del Grupo B fue 90.40 mIU/mL y el más alto fue
73,970 mIU/mL con una media aritmética de 8,708.32 mIU/mL y una media
geométrica de 2,179.32 mIU/mL
Gráfico 1.- Menores de 19 años de edad
Títulos de Seroconversión.

Gráfico 2.- Mayores de 19 años de edad
Títulos de Seroconversión.
Seguridad.
Un total de 7 reacciones adversas (4.69%) se registraron en las 201 dosis aplicadas en ambos grupos
(tabla No.1).
Tabla No. 1.- Efectos adversos locales y sistémicos
después de la aplicación de 201 dosis.

DISCUSIÓN
La Organización Mundial de la Salud (OMS) recomendó en 1991 que la
vacuna para Hepatitis B debería ser integrada al programa nacional de
inmunizaciones en todos los países con prevalencia de portadores de
Hepatitis B del 8% o superior a esta cifra y desde 1997 en todos los
países del mundo.
Si bien es cierto, que la infección
por hepatitis B puede ser prevenida, este sigue siendo un problema de
salud en países con alta prevalencia de la enfermedad. En algunos
estudios el porcentaje de individuos que no desarrollan anticuerpos
protectores después de tres dosis de vacuna corresponden del 5% al 10% y
en tanto continúan en riesgo de la infección, en este grupo se
encuentran los sujetos de edad avanzada, los mal nutridos,
inmunodeficientes, drogadictos endovenosos, varones, fumadores,
pacientes con enfermedades crónicas, entre otros (7)(8).
Muchos esfuerzos para mejorar este problema se ha hecho, como aumentar
las dosis de vacuna, fabricar diferentes clases de vacunas entre las
que contienen los antígenos preS1 y PreS2, o asociarse a otras drogas
para mejorar la respuesta como los interferones o la Thimosina. (8)(9) y
otros intentos también se han evaluado para reducir el número de
dosis.
La clásica vacuna de DNA recombinate de
Hepatitis B usa Saccharomyces cerevisae, la cual ha demostrado ser
efectiva en muchas publicaciones con porcentajes de seroconversión del
70.7% (3) al 98.2% Kang et al. (9); Sin embargo, las vacunas que usan
el sistema de Saccharomyces cerevisae tienen algunas limitantes:
Limitantes de S. cerevisiae como huésped para la producción de proteínas heterólogas
- Frecuentemente es difícil obtener altos campos de producción.
- Baja estabilidad del Plásmido.
- Se produce hiperglicosilación de las glicoproteínas. (La longitud de
proteínas de las cadenas de manosa es en promedio, más de 40. Con H.
Polymorpha es sólo de 8-14 unidades).
De esta manera se afectan significativamente la inmunogenicidad, actividad, y vida media del producto" (10)
Este estudio demuestra que la vacuna de Hepatitis B Hepavax Gene es
inmunogénica en personas sanas peruanas, mayores de 10 años, alcanzando
títulos protectores del 100% y con respuesta superior a 100mIU/mL en el
97.29% de los vacunados en el grupo A y con respuesta superior a 100
mIU/mL del 93.33% en el grupo B, resultados comparables a este fueron
obtenidos en otras publicaciones (12) (13) (14).
Esta
vacuna de DNA recombinante fue también encontrada ser bien tolerada y
segura en esta serie de pacientes y entre otras publicaciones (12) (13)
(14).
Ningún evento adverso severo fue encontrado, la mayoría de las reacciones fueron locales y se resolvieron espontáneamente.
Debemos destacar que los títulos de seroconversión observados en las
personas del grupo A son más elevados que en el grupo B. justificamos
estos resultados porque la mejor respuesta siempre se ve en pacientes
jóvenes; por otro lado, los títulos son realmente altos comparativamente
con otros estudios. (3) (13) (14)(15).
Sobre la
respuesta de anticuerpos anti Hepatitis B (anti HBsAg) se acepta que son
respondedores inmunes los que hacen un título de 10 mUI/mL o
superiores. A más alto el título más persisten los anticuerpos anti
HBsAg Cuando el título de anti HbsAg cae por debajo de 10 la infección
puede ocurrir pero siempre será subclínica y en general sin lograr
detectarse el HBsAg en el suero. No hay estudios que muestren que hay
casos agudos entre respondedores pero si algunos asintomáticos y ninguno
con evidencia de convertirse en portadores crónicos. (16) (17)
CONCLUSIÓN
1. 67 personas terminaron el estudio de un total de 188 personas admitidas inicialmente.
2. La inmunogenicidad fué satisfactoria: 100% de los participantes en
el Grupo A y 100% de los participantes del Grupo B. Con una media
aritmética de 28,583.92 mIU/mL y una media geométrica de 5,754.32 mIU/mL
en el Grupo A. Con una media aritmética de 8,708.3 mIU/mL 2 y una
media geométrica de 2,179.32 mIU/mL en el Grupo B. El título medio
geométrico (5,754.32 mIU/mL) del grupo A es de los más altos publicados
para Hepavax Gene.
3. Los eventos adversos fueron del 4.69%. Ninguno fue severo.
4. La vacuna de DNA recombinante derivada de H. Polymorpha es
inmunogénica y segura en personas sanas peruanas mayores de 10 años
aplicada en tres dosis los días 0, 30 y 180 días.
REFERENCIAS BIBLIOGRÁFICAS
1. ELOY RUIZ, MARIBEL ALMONTE, RONNY PIZARRO y Col. Infección con Virus
de la Hepatitis B y Hepatitis C como factores de riesgo para
hepatocarcinoma en el Perú. Estudio de casos y controles. Rev
Gastroenterol Perú 1998. 18: 199 -212.
2. ROLANDO N; FIGUEROA R; TAKANO J y col Estudio clínico, Bioquímico y anatomopatológico de los portadores de Antígeno de Superficie de la Hepatitis (HBsAg) en Abancay. Rev Gastroenterol Perú, 1983 - 1: 22-32.
3. COLICHÓN, A; VILDÓSOLA H, SJOGREN M; et al Respuesta serológica a una vacuna DNA recombinante en nativos residentes de dos areas Hiperendémicas hepatitis B en la Amazonía Peruana. Rev Gastroenterol Perú, 1993; 13: 78-84
4. CABEZAS CESAR; GOTUZZO EDUARDO; ESCAMILLA JOEL; PHILLIPS IRVING. Prevalencia de Marcadores serológicos de hepatitis Viral A, B, Y Delta en escolares aparentemente sanos de Huanta (Perú). Rev Gastroenterol Perú, 1994; 14: 123-134.
5. INDACOCHEA S, GOTUZZO E. Mortalidad por Hepatitis Viral B en Abancay Rev Gastroenterol Perú,1993; 13; 173 - 177.
6. GELLISEN G, WEYDEMANN U, STRASSER A. W M et al. Progress in developing methyltrophic yeast as expression systems. Tibtech 1992; 10: 413-417.
7. GROP PJ; JAIG W, MILME A et al Unresolved issues in hepatitis B immunization in viral hepatitis and liver diseases (Ed: Hollinger FB, Lemon SM, Morgolic II) Williams and Wilkins. Baltimore USA 1991 pg 856-860.
8. GELLISEN G. Hansenula Polymorpha: Biology and applications. Chapter 12 Recombinant hepatitis B vaccines- diseases characterization and vaccine production 2002: 175-200.
9. EYIGUN CP, YILMAZ S, GUL C, SENGUL A, Hacibektasoglu A, Van Thiel DH. et al. A comparative trial of two surface subunit recombinant hepatitis B vaccines vs a surface and PreS subunit vaccine for immunization of healthy adults. J Viral Hepat. 1998 Jul; 5(4):265-9.
10. KANG, J KIM, Y. KIM K. Immunogenicity and Safety of HB vaccine derived by test. The Korean J Intern Med 1986; 31,318-322.
11. BUCKHOLZ, R.G., GLEESON M.A. Biol Technology, 1991; 9;1067-1072.
12. ABRAHAM P. NANDWANIL S, SRIVASTAVA A.K. Timmermans I.T.F. Immunogenicity and safety of Hepavax-Gene recombinant Hepatitis B vaccine in healthy adolescents between the ages of 15 to 19 years. 10th ICID March 2002; Singapore 11-14.
13. P. ABRAHAM, TS NARAYANAN, FP Mistry - Safety and Immunogenicity of an r-DNA Hepatitis B Vaccine (Hepavax-gene) in Healthy Indian Adults - JAPI, (2000) - Vol 48.
14. ZAPATA F R. Hepatitis B: Inmunogenicidad de la vacuna. Hepavax-Gene en Trabajadores de la salud COMFANDI: Cali 1999-2000. S.C.T. 2001 - Vol. 4 (1) 20-28.
15. NGUYEN TRONG HIEU Safety and Immunogenicity of Recombinant Hepatitis B Vaccine. News of Medicine and Pharmacy. , 1996 - 10: 27-32.
16. PLOTKIN SA, ORENSTEIN WA (eds) "Vaccines" 2nd edition. Ed Saunders London 4 2001: 169.
17. MANDELL, Douglas and Bennets "Principles and practice of infectious
diseases" 4th Ed Churchill N York 1995: 1429.