TRABAJOS ORIGINALES
Metaplasia Intestinal en la unión esófago-gástrica, frecuencia y correlaciones
Fernando Barreda Bolaños1; Juvenal Sánchez Lihon2; Waldo Tello Huamaní3; Regina Gómez Ponce3; Mauricio Díaz del Olmo3
1 Servicio de Gastroenterología del Departamento de Abdomen del INEN
2 Departamento de Patología del INEN
3
Médicos Residentes de Gastroenterología, rotación externa.
RESUMEN
La incidencia del adenocarcinoma alrededor de la unión esófago-gástrica está en incremento. La significación de la metaplasia intestinal encontrada en muestras obtenidas de la unión esófago-gástrica de aspecto normal no es clara. El propósito del presente reporte ha sido el definir la frecuencia de presentación de la metaplasia intestinal en la unión esófago-gástrica con apariencia endoscópica normal y precisar sus relaciones clínicas, endoscópicas e histológicas. METODOS: Se evaluaron 239 pacientes referidos para gastroscopía. De 192 pacientes que formaron el grupo de estudio, se compararon 02 grupos. El grupo I, incluyó 40 pacientes con metaplasia intestinal en la unión esófago-gástrica y el grupo II, estuvo conformado por 152 pacientes con ausencia de la misma. Se tomaron muestras de biopsia tanto por encima como por debajo de la unión escamo-columnar y del antro gástrico. Las muestras fueron procesadas con hematoxilina-eosina. RESULTADOS: Se encontró metaplasia intestinal en la unión esófago-gástrica en 40 pacientes (21%). La metaplasia estuvo asociada con un grupo etáreo mayor (p=0.002), y con la metaplasia intestinal en antro (p<0.001)(OR: 14.6). No hubo asociación con la enfermedad del reflujo gastro-esofágico. CONCLUSION: La metaplasia intestinal en la unión esófago-gástrica ocurre frecuentemente en pacientes peruanos. Está asociada con el incremento de edad y con la metaplasia intestinal en antro, pero no con la enfermedad del reflujo gastro-esofágico.
Palabras claves: Metaplasia Intestinal, Unión esófago-gástrica, frecuencia, correlaciones.
SUMMARY
The incidence of adenocarcinoma around the esophagogastric junction is icreasing. The significance of intestinal metaplasia found in biopsy taken from normal appearing squamocolumnar junction is not clear. The aim of this study was to define the frequency of intestinal metaplasia at normal-appearing esophagogastric junction and clinical, endoscopic and histological associations. METHODS: 239 patients referred for gastroscopy participated in the study. Of 192 patients, two groups were compared. Group I included 40 patients with metaplasia intestinal at the esophagogastric junction and group II included 152 patients with no metaplasia intestinal at the same location. Biopsy specimens were taken from above and below the squamocolumnar junction, and gastric antrum The biopsy specimens were stained with haematoxylin-eosin. RESULTS: Intestinal metaplasia at the squamocolumnar junction was found in 40 patients (21%). Metaplasia was associated with icreasing age (p=0.002) and antral intestinal metaplasia (p<0.001)(OR 14.6). There was no association with gastro-oesophageal reflux disease. CONCLUSION: Intestinal metaplasia at the esophagogastric junction occurs frequently in Peruvian patients. It is associated with increasing age and antral intestinal metaplasia but not gastro-esophageal reflux disease.
Key words: Intestinal metaplasia, esophagogastric junction, frequency, correlations.
INTRODUCCIÓN
El adenocarcinoma alrededor de la unión esófago-gástrica está en incremento y la presencia de metaplasia intestinal en esta región es motivo de constante evaluación. El significado del hallazgo de la metaplasia intestinal en la unión esófago-gástrica en pacientes peruanos, es motivo del presente trabajo, así como el de poder determinar su frecuencia y las correlaciones clínicas, endoscópicas e histológicas respectivas.
MÉTODOS
Pacientes
El estudio fue llevado a cabo en el Servicio de Gastroenterología del Departamento de Abdomen del Instituto de Enfermedades Neoplásicas "Dr. Eduardo Cáceres Graziani", que pertenece a la ciudad de Lima, Perú. Se seleccionaron aquellos pacientes que acudieron al Servicio en el período comprendido entre noviembre del 2000 y junio del 2001, por presentar una sintomatología de epigastralgia, síntomas de reflujo gastro-esofágico, dispepsia, llenura, nauseas y vómitos.
Los criterios de exclusión considerados fueron los siguientes: presencia de esófago de Barrett, hernia hiatal esofágica, candidiasis esofágica, desórdenes de coagulación, así como lesiones elevadas o deprimidas en la unión gastro-esofágica.
Todos los pacientes firmaron un consentimiento autorizando el procedimiento y fueron sometidos a un cuestionario donde se consignaron los datos referentes a edad, sexo, tiempo de enfermedad, y sintomatología.
Ingresaron al estudio un total de 239 pacientes cuya característica fue el aspecto normal endoscópico de la Unión Esófago-Gástrica.
Endoscopía
Los exámenes endoscópicos fueron realizados por los investigadores del presente trabajo. Se identificaron a los pacientes, en los cuales la Unión Esófago-Gástrica (UEG) coincidiese con la Unión Escamo-Columnar (UEC). En la mayoría de los casos hubo dicha coincidencia; en aquellos pacientes donde no la hubo, nosotros consideramos como normal a aquél segmento de 0 hasta 10 mm en el margen referido.
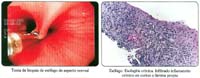
Se tomaron biopsias en los siguientes niveles: 02 biopsias en esófago distal, 02 biopsias en la unión esófago-gástrica (cardias), y 02 biopsias en el antro; además se tomaron biopsias adicionales por patología concomitante cuando fue necesario, lo que hizo un total aproximado de 1,500 muestras en los 07 meses de duración del presente trabajo.
Las muestras en esófago distal y en la unión esófago-gástrica, se tomaron en la mucosa adyacente a la unión escamo-columnar, tanto inmediatamente por encima como por debajo de la misma y dentro de un radio de 1 cm respectivamente.
Las muestras de la unión esófago-gástrica, se obtuvieron con afrontamiento endoscópico directo y en algunos casos a través de la maniobra de retroversión (u-turn).
Patología
Todas las biopsias fueron fijadas en formalina, procesadas en parafina y teñidas con hematoxilina-eosina.
Las muestras fueron analizadas en su totalidad por uno de los investigadores del presente trabajo.
Estadística
El análisis fue realizado utilizando el paquete software SPSS 9.0 para Windows. Se utilizaron los tests del chi-cuadrado, y el t-test.
RESULTADOS
El grupo inicial fue de 239 pacientes que presentaron la apariencia normal de la unión esófago-gástrica desde el punto de vista endoscópico. Se excluyeron de la población de estudio a los pacientes que tuvieron concomitantemente neoplasia maligna gástrica (n=34), además se excluyeron también los pacientes portadores de gastrectomía subtotal por cirugía previa con relación a patología tumoral (n=13). Sin embargo, al apreciar la frecuencia de presentación de la metaplasia intestinal en la UEG en el grupo de pacientes operados, esta fue del 30% y de los portadores de neoplasia maligna fue del 35%. Figura (1) .
Nuestra población de estudio fue de 192 pacientes que fueron a su vez categorizados en 02 grupos, de los cuales el grupo I estuvo constituido por 40 pacientes que presentaron metaplasia intestinal en la unión esófago-gástrica y el grupo II que estuvo integrado por 152 pacientes con ausencia de la misma, en dicha localización.
Como dato referencial, el grupo inicial de 239 pacientes presentó una frecuencia de metaplasia intestinal en la UEG de 23%, y el grupo de estudio de 192 pacientes presentó una frecuencia de metaplasia intestinal en la UEG de 21%.
Los datos referentes a los grupos I y II se muestran en las tablas (1) y (2). Como se puede apreciar en la tabla 1, no hubo mayor diferencia entre ambos grupos cuando se comparó el sexo, el tiempo de enfermedad y los síntomas. Sin embargo, encontramos una diferencia significativa entre ambos grupos respecto a la edad, siendo el promedio etáreo de los pacientes del grupo I de 59.9 años, con relación a los del grupo II, cuya edad promedio fue de 52.0 años, (p: 0.002). Ambos grupos no presentaron relación significativa con la sintomatología de reflujo gastro-esofágico (pirosis 17% y RGE 5% en el grupo I, respecto al 10.5% y 3.9% del grupo II).
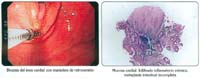
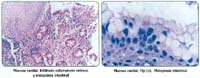
La tabla 2, nos muestra que la presencia de helicobacter pylori (HP) tanto en la UEG como en el antro no difieren significativamente en ambos grupos, de la misma manera sucede con la presencia de carditis y esofagitis, sin embargo debemos resaltar la alta frecuencia de presentación de carditis en ambos grupos (97.5% y 98.7%) como de esofagitis (65% y 56.6%) en una mucosa de apariencia endoscópica normal. De la misma manera queremos puntualizar que la presencia de helicobacter pylori tanto en la UEG (32.5% y 39.5%) como en el antro (42.5% y 55.3%) es la mínima detectada en la situación real de nuestro trabajo diario, esto es, refleja el hallazgo de HP con hematoxilina y eosina, ya que por razones presupuestales no se hicieron tinciones adicionales ni estudios serológicos complementarios para la mejor detección del HP, esto significa que es probable que haya un mayor número de pacientes con HP en nuestra población de estudio, pero en todo caso, una detección ampliatoria o complementaria de HP, afectaría por igual o aleatoriamente a ambos grupos. Se reporta además, la presencia de metaplasia intestinal focal en mucosa de esófago con apariencia normal en ambos grupos pero en porcentajes muy bajos (5% y 1.3%), figura 2. Cuando se analiza la presencia de metaplasia intestinal en antro, se puede apreciar con claridad una diferencia significativa del grupo I con 77.5% con respecto al grupo II de solo 19.1% (p<0.001) y un OR de 14.6, lo que nos muestra una fuerte correlación de la presencia de metaplasia intestinal en la UEG con la presencia de la misma en antro, dentro de un contexto evidente de pertenecer a un grupo etáreo mayor.
Como se aprecia en la figura 2, la variedad predominante de metaplasia intestinal fue la mixta en el grupo I, tanto en la UEG como en el antro, y además coincidentes en frecuencia (80% y 83.9%), de la misma manera, se puede apreciar que la variedad predominante de metaplasia intestinal en el antro en el grupo II, fue también la forma mixta (75.9%). La metaplasia intestinal incompleta en todos los casos, tiene una frecuencia de presentación de alrededor del 10%.
Finalmente, en las figuras 3-5, se muestran fotos representativas de diversos pacientes de nuestro estudio, para precisar de una mejor manera la relación entre los hallazgos endoscópicos e histológicos referidos.
DISCUSIÓN
Se define la metaplasia intestinal como un cambio reversible en el cual un tipo celular adulto (epitelial o mesenquimal) es reemplazado por otro tipo de células adultas. Esto puede representar una sustitución adaptativa de células más sensibles al stress por otro tipo de células más capaces de sobrellevar el medio adverso. Sin embargo, la metaplasia epitelial es una espada de doble filo, porque en diversas circunstancias las influencias que predisponen la aparición de tal metaplasia, si son persistentes, pueden inducir transformaciones neoplásicas en el epitelio metaplásico (33), esto implica que la metaplasia intestinal, puede comenzar como un fenómeno regenerativo transitorio, pero si se produce una lesión repetida -infección sostenida- la metaplasia puede extenderse y ser permanente (34). En general, la mucosa del estómago consiste de glándulas pilóricas, cardiales y fúndicas, con o sin metaplasia epitelial del tipo intestinal. La metaplasia intestinal ocurre primero en la mucosa de las glándulas pilóricas a través de la curvatura menor y gradualmente se disemina al resto del estómago. La manera de diseminación de la metaplasia intestinal no es continua sino multicéntrica. Se han descrito dos patrones de diseminación de la metaplasia intestinal del estómago: siendo el primero el patrón ordinario, el cual presenta la diseminación de la metaplasia intestinal simultáneamente en cardias y en antro, avanzando conjuntamente a través de la curvatura menor hasta finalmente encontrarse, como expresión de un proceso de envejecimiento; siendo el otro patrón el llamado atrófico, en este caso, los límites de la metaplasia intestinal circunscriben básicamente parte del fondo gástrico, pues el resto está comprometido por el patrón atrófico y a medida que pasan los años, el patrón ordinario disminuye y el patrón atrófico se incrementa (12).
Cuando se describe la presencia de helicobacter pylori en estómago, se sugiere una clasificación de gastritis crónica en tres patrones: el primero o patrón autoinmune, el segundo o gastritis antral difusa o hipersecretora, con alta presencia de helicobacter pylori asociada a úlcera duodenal, en poblaciones con poca incidencia de neoplasia gástrica, y el tercer patrón de la llamada gastritis atrófica multifocal o ambiental, muy prevalente en poblaciones con alto riesgo de hacer cáncer gástrico, donde se aprecia la presencia de metaplasia intestinal preferentemente en antro, curvatura menor, ángulo y desde arriba, cardias y curvatura menor corporal (5).
Recientemente se han precisado 04 tipos de patrones topográficos de la metaplasia intestinal en estómago, siendo el primero de la variedad focal en antro, el segundo llamado "predominantemente antral", el tercero llamado del tipo "MagenstraBe", esto es, que compromete a manera de un canal el estómago desde el cardias hasta el antro a través de la curvatura menor y el último, llamado "patrón difuso", que compromete todo el estómago con excepción de áreas fúndicas; la connotación de los patrones descritos previamente radica en su asociación con el riesgo de desarrollar cáncer. El patrón "MagenstraBe", tiene un riesgo de cáncer que es 6 veces mayor que los patrones focal y antral; el patrón difuso, tiene un riesgo de cáncer 12 veces mayor. (3).
De acuerdo a los datos del presente reporte, apreciamos que la frecuencia de presentación de la metaplasia intestinal en la UEG es importante, pues 1 de cada 5 pacientes con apariencia endoscópica de normalidad, tiene cambios histológicos de metaplasia intestinal, que a su vez se correlaciona de una manera directa con un grupo etáreo cuyo promedio de edad es de 60 años (p: 0.002), y que tiene concomitantemente una presencia significativa de metaplasia intestinal en antro, respecto al grupo control (p<0.001 y OR de 14.6). Estos hallazgos sugieren que nuestra población tenga una forma frecuente de gastritis de la variedad "MagenstraBe", o del "tipo ambiental", o del llamado "patrón ordinario", todas las cuales se observan en poblaciones con alta prevalencia de cáncer gástrico como la nuestra (37).
La frecuencia de presentación de la metaplasia intestinal en la UEG en nuestra población de estudio fue del 21%, lo que está de acuerdo a reportes previos, que sitúan dicho hallazgo en rangos amplios que van del 9 al 36% (2,7,8,10,11,13,15-18,25-28), con un promedio calculado sobre 2,585 pacientes de 14%(25), en nuestra población sin embargo, cuando evaluamos dicha frecuencia en el grupo de pacientes con UEG normal y estómago operado (por lesión tumoral) esta cifra se incrementó al 30%, y más aún, dicho valor fue del 35% en aquellos pacientes con UEG normal y presencia concomitante de adenocarcinoma y linfoma gástrico, lo que está en concordancia con la relación conocida de carcinoma gástrico y metaplasia intestinal (35,36).
En el INEN, se ha demostrado previamente por uno de los autores del presente trabajo, que sobre un total de 89 pacientes con carcinoma gástrico, se encontró metaplasia intestinal en 77.6% de los carcinomas diferenciados tubular y/o papilar, y en 41% de los carcinomas indiferenciados mucocelulares (21), y en otro reporte reciente con pacientes de nuestro hospital, se demuestra que la presencia de metaplasia intestinal es significativamente mayor en los pacientes con cáncer gástrico que en los pacientes sin neoplasia (p=0.001) (41). De otro lado, se debe recordar para no perder la perspectiva, que prácticamente todas las personas mayores de 40 años tienen algún grado de cambios inflamatorios en el antro, y que si bien en un tiempo, la metaplasia intestinal fue considerada una lesión precursora del carcinoma gástrico, se acepta ahora que la metaplasia intestinal sea básicamente uno de los signos de una lesión inflamatoria crónica y que se requieren factores adicionales que sobre este sustento, permitan la presencia del carcinoma gástrico (29,38).
Se tiene la impresión de que la variedad de metaplasia con mayor relación a la presencia del carcinoma gástrico sea la del tipo incompleto II B (29,38), en el estudio referido en nuestro hospital, la variedad completa fue del 52.3%, la incompleta de 11.1% y la forma mixta del 36.5% (21). En el presente reporte, la forma predominante de presentación en todos los casos fue la mixta, con alrededor del 80%, tanto en el área de la UEG como en el antro, (de los grupos I y II), lo que sugiere que nuestra población posea un terreno fértil para la presentación del carcinoma gástrico por el notable compromiso de variedad mixta (incompleta + completa), para que aunado a otros factores agresivos gástricos persistentes tanto genéticos como ambientales, un grupo de nuestros pacientes finalmente pueda desarrollar cáncer gástrico, pudiendo tener sustento además, que el compromiso de la UEG con metaplasia intestinal sirva como sostén o apoyo para una mayor presencia de carcinoma gástrico en el polo superior gástrico o área cardial.
Algunos autores recientemente han propuesto que la mucosa cardial no sería parte de la estructura normal del estómago sino más bien una lesión adquirida como consecuencia del reflujo gastro-esofágico sobre el epitelio escamoso (4,6,14), sin embargo, estudios recientes sobre la base de autopsias en población infantil (rango etáreo de 16 días a 18 años), demuestran la presencia del epitelio cardial en todos los especímenes en una longitud promedio de 1.8 mm. Estos resultados no hacen sino consolidar el concepto de que el cardias gástrico está presente desde el nacimiento como una estructura normal (9). De la misma manera, hay autores que sugieren que la presencia del adenocarcinoma en el esófago de Barrett y el adenocarcinoma de cardias, podrían representar la misma entidad (20), y otros inclusive plantean que la patogénesis del cáncer de cardias tendría un sustento en el reflujo gastro-esofágico sobre la mucosa cardial, que luego se afectaría con la presencia de metaplasia intestinal, displasia y carcinoma (30), sin embargo, nuestros resultados acerca de la relación de presencia de metaplasia intestinal en la UEG y la sintomatología asociada de reflujo gastro-esofágico es muy pobre (pirosis 17.5% y 10.5%, RGE 5% y 3.9%), lo mismo que ha sido reportado previamente por otros autores (2,22,31,39). De otro lado, cada vez hay mayor evidencia de que la metaplasia intestinal en la UEG es una entidad diferente de la metaplasia intestinal en esófago, estando más relacionada la metaplasia intestinal en esófago (Barrett), con el reflujo gastro-esofágico, con la ausencia de HP, con la presencia de metaplasia intestinal incompleta, con el patrón de citoqueratina frecuente y con un riesgo de cáncer mayor, (22,25).
Para definir donde termina el esófago y donde empieza el estómago, hay situaciones evidentemente controvertibles (23), sin embargo, en la mayoría de los casos hay una concordancia entre la unión esófago-gástrica y la unión escamo-columnar (32), cuando no, hay autores que recomiendan considerar como normal dicho segmento, siempre y cuando éste no sea mayor de 10 mm. (31), aunque se sabe que algunos pacientes puedan tener la mucosa cardial algunos centímetros por encima de la unión esófago-gástrica (39).
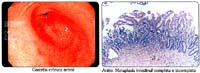
Cuando evaluamos los resultados de las muestras obtenidas del esófago distal con aspecto endoscópico normal, la alteración histológica encontrada de "infiltrado inflamatorio crónico en la lámina propia e intraepitelial", en ambos grupos (65% y 56.6% respectivamente), es relevante y suele explicarse como ser parte del "reflujo gastro-esofágico fisiológico"(40), además, la presencia de focos de metaplasia intestinal en esófago de "aspecto conservado" (5% y 1.3%), podría corresponder al denominado "Barrett ultramicroscópico", sin mayor repercusión clínica ni endoscópica, a diferencia de la presencia de metaplasia intestinal hacia el área cardial de la UEG (24); todo lo cual nos lleva a precisar que, para hacer una interpretación adecuada de estos hallazgos, se debe considerar que nosotros hemos obtenido las muestras en dicha localización para fines de investigación, pues en general se recomienda que la toma de muestras en esófago se circunscriba a los casos de patología endoscópicamente definida como erosiones, úlcera o neoplasia (40). Sin embargo, cuando también objetivamos que la inflamación crónica del cardias en ambos grupos es muy alta (97.5% y 98.7% respectivamente), por un lado debemos recordar que ya se ha precisado que la presencia de gastritis crónica en pacientes mayores de 40 años es prácticamente la norma (38), y por otro, que el punto de vista tradicional de que "la ausencia de daño macroscópico al tejido implicaba normalidad", se hace más evidente ahora, que la frontera entre lo que se entiende por fisiológico y patológico, se torna cada vez más tenue (1).
No hemos encontrado diferencia significativa en cuanto a la presencia del helicobacter pylori tanto en UEG como en antro, respecto a ambos grupos (32.5% y 39.5% en UEG; 42.5% y 55.3% en antro). La frecuencia de presentación de HP en antro, en el grupo de pacientes sin metaplasia en la UEG (55.3%), con detección basándose en hematoxilina-eosina, es semejante a la reportada en otros centros de nuestro medio (61%) (41), pero cuando se ha investigado con técnicas adicionales la presencia de HP en nuestra población, se ha encontrado infección por HP en alrededor del 50% en niños peruanos de 1 a 12 años de edad con nivel socioeconómico bajo (42,43). Dicha frecuencia se incrementa con la edad, alcanzando por lo menos el 75% durante la adultez (44,46). La relación de metaplasia intestinal con la presencia de helicobacter pylori ha sido evidenciada según la población y grupo etáreo estudiado, tanto en adolescentes como en población adulta, no encontrándose metaplasia intestinal en la población de 30 adolescentes evaluados y reportándose una frecuencia del 21% de metaplasia intestinal en 102 adultos con dispepsia (45,46). Nuestros datos de los grupos de estudio I y II, sugieren una relación inversa respecto a la presencia de metaplasia intestinal antral y la presencia de helicobacter pylori en antro, esto es, a menor compromiso de metaplasia intestinal en antro (19.1%), mayor probabilidad de HP antral (55.3%), y a mayor compromiso de metaplasia intestinal en antro (77.5%), menor probabilidad de HP (42.5%), sin embargo, cuando agrupamos a todos aquellos pacientes portadores de metaplasia intestinal (60), respecto a aquellos que no la tienen (132), no encontramos diferencia significativa entre ambos grupos, respecto a la presencia o no de HP (p= 0.740). Estos datos, esbozan la relación directa que existe entre los grupos de estudio evaluados, respecto al factor evidente de envejecimiento.
En conclusión, nuestros resultados muestran que existe una correlación significativa entre la presencia de metaplasia intestinal en la UEG y en el antro, respecto al grupo control (p<0.001 y OR de 14.6), asociado a un grupo etáreo mayor (p= 0.002), no encontrándose mayor relación con la sintomatología de reflujo gastro-esofágico.
AGRADECIMIENTO
El presente trabajo fue llevado a cabo con la valiosa colaboración de la Dra. Dolly Quispe y de la Sra. María Farfán.
BIBLIOGRAFÍA
1. A. Attwood Stephen E., Morris Clive D. Who defines Barrett's oesophagus: endoscopist or pathologist?. European Journal of Gastroenterology & Hepatology 2001, Vol 13, No. 2. Pag.97-99.
2. Byrne JP, Bhatnagar S, et al. Comparative study of intestinal metaplasia and mucin staining at the cardia and esophagogastric junction in 225 symptomatic patients presenting for diagnostic open-access gastroscopy. Am J Gastroenterol 1999 Jan; 94(1):98-103.
3. Mauro Cassaro, Rugge Massimo, et al. Topographic Patterns of Intestinal Metaplasia and Gastric Cancer. The American Journal of Gastroenterology, Vol 95, No.6, 2000, pp 1431-8.
4. Para Chandrasoma. Pathophysiology of Barrett´s Esophagus. Seminars in Thoracic Cardiovascular Surgery, Vol 9, No.3 (July), 1997: pp 270-8.
5. Correa Pelayo. Helicobacter pylori y la Carcinogénesis Gástrica. The American Journal of Surgical Pathology 19 (Suplemento 1):S37-S43,1995.
6. DeMeester Steven R, Campos M. R. Guilherme, et al. The impact of an Antireflux Procedure on Intestinal Metaplasia of the Cardia. Annals of Surgery, Vol 228, No.4, Oct 1998.
7. El-Serag HB, Sonnenberg A, et al. Characteristics of intestinal metaplasia in the gastric cardia. Am J Gastroenterol 1999 Mar;94(3):622-7.
8. Hirota WK, Loughney TM, et al. Specialized intestinal metaplasia, dysplasia, and cancer of the esophagus and esophagogastric junction: prevalence and clinical data.Gastroenterology 1999 Feb;116(2):277-85.
9. Kilgore Sony P., Ormsby Adrian H. , et al. The Gastric Cardia: Fact or Fiction?. Am J Gastroenterol. Vol 95, No. 4, 2000, pp 921-4. 10. Morales TG, Bhattacharyya A, et al. Is Barrett´s esophagus associated with intestinal metaplasia of the gastric cardia?.Am J Gastroenterol 1997 Oct;92(10):1818-22.
11. Morales TG, Sampliner RE, et al. Intestinal metaplasia of the gastric cardia. Am J Gastroenterol 1997 Mar;92(3):414-8.
12. Nakamura Kyoichi. Structure of the Gastric Carcinoma. Igakushoin Ltd. Tokyo, in 1982.
13. Nakamura M; Kawano T; et al. Intestinal metaplasia at the esophagogastric junction in Japanese patients without clinical Barrett's esophagus. Nakamura M - Am J Gastroenterol - 1999 Nov;94(11):3145-9.
14. Oberg S, Peters JH, et al. Inflammation and specialized intestinal metaplasia of cardiac mucosa is a manifestation of gastroesophageal reflux disease. Ann Surg 1997 Oct;226(4):522-30; discussion 530-2.
15. Ormsby AH; Kilgore SO, et al. The location and frequency of intestinal metaplasia at the esophagogastric junction in 223 consecutive autopsies: implications for patient treatment and preventive strategies in Barrett's esophagus. Mod Pathol 2000 Jun;13(6):614-20.
16. Peck-Radosavljevic M, Puspok A, et al. Histological findings after routine biopsy at the gastro-oesophageal junction. Eur J Gastroenterol Hepatol 1999 Nov;11(11):1265-70.
17. Pieramico O, Zanetti MV. Relationship between intestinal metaplasia of the gastro-oesophageal junction. Helicobacter pylori infection and gastro-oesophageal reflux disease: a prospective study. Dig Liver Dis. 2000 Oct, 32(7):567-72.
18. Polkowski W, M. R. Van Lanschot JJ, et al. Intestinal and pancreatic metaplasia at the esophagogastric junction in patients without Barrett's esophagus. Am J Gastroenterol 2000 Mar; 95(3):617-25.
19. Riddell Robert H . Problems with the Histological Diagnosis of Barrettos Epithelium (BE) and Dysplasia nad its Implications. Thirteenth International Course on Therapeutic Endoscopy. October 11,12, 13 and 14, 2000. Toronto, Canada. Addendum.
20. Ruol A, Parenti A, et al. Intestinal metaplasia is the probable common precursor of adenocarcinoma in barrett esophagus and adenocarcinoma of the gastric cardia.. Cancer 2000 Jun 1; 88(11):2520-8.
21. Sánchez Lihon Juvenal. Cáncer "Precoz" de Estómago en el Instituto Nacional de Enfermedades Neoplásicas. Acta Cancerológica. 1990, Vol XXI, No. 1, pp 11-9.
22. Prateek Sharma. Barrett's Esophagus: Definition and Diagnosis. Prateek Sharma, Richard E. Sampliner Eds. Blacwell Science 2001, 1: pp 1-7.
23. Spechler Stuart Jon. Esophageal columnar metaplasia (Barrett's esophagus). Precancerous Conditions and Endoscopic Screening. Gastrointestinal Endoscopy Clinics of North America.Vol 7, Number 1, Jan 1997, pp 1-18. 24. Spechler SJ. Short and ultrashort Barrett's esophagus - what does it mea. Semin Gastrintest Dis 1997 Apr;8(2):59-67.
25. Spechler Stuart Jon. What´s New in Barrett's. Gastroenterology and Hepatology at the Millennium and Beyond. AGA Postgraduate Course, May 20-21, 2000. pp 1-16.
26. Trudgill NJ, Suvarna SK, et al. Intestinal metaplasia at the squamocolumnar junction in patients attending for diagnostic gastroscopy. Gut 1997 Nov;41(5):585-9.
27. Voutilainen M, Farkkila M, et al. Chronic inflammation at the gastroesophageal junction (carditis) appears to be a specific finding related to Helicobacter pylori infection and gastroesophageal reflux disease. The Central Finland Endoscopy Study Group. Am J Gastroenterol 1999 Nov; 94(11):3175-80.
28. Voutilainen M; Farkkila M; et al. Specialized columnar epithelium of the esophagogastric junction: prevalence and associations. The Central Finland Endoscopy Study Group. Am J Gastroenterol 1999 Apr;94(4):913-8.
29. Shaw Watanabe, Shoichiro Tsugane, Naohito Yamaguchi. Part II: Etiology. Gastric Cancer. T. Sugimura and M. Sasako Eds, 1997. pp 33-51.
30. Wilfred M. Weinstein. Precursor Lesions for Cancer of the Cardia. Precancerous Conditions and Endoscopic Screening. Gastrointestinal Endoscopy Clinics of North America.Vol 7, Number 1, Jan 1997, pp 19-28.
31. Wolf Claudia, Selderijk Cornelis A., et al. Epidemiological, clinical, and histological characteristics of intestinal metaplasia at the oesophagogastric junction compared to short segments of columnar-lined oesophagus. European J Gastroenterol & Hepatol 2001, Vol 13 No.2,113-120.
32. Boyce H. Worth. Endoscopic definitions of esophagogastric junction regional anatomy.Thirteenth International Course on Therapeutic Endoscopy. October 11,12, 13 and 14, 2000. Toronto, Canada. Page 11-11.8.
33. Stanley Robbins. Cellular injury and adaptation. In Pathological basis of disease. Third Edition. 1984. W.B. Saunders Company.
34. Sobala GM, O´Connor HJ, et al. Histological consequences of bile reflux on the gastric mucosa with special reference to intestinal metaplasia. J Clin Pathol 46:235-240, 1993.
35. Morson B.C. Carcinoma arising from areas of intestinal metaplasia in the gastric mucosa. Br. J. Cancer 9:377-385, 1955.
36. Ming S.C. Precursors of gastric cancer. Praeger Publishers. New York, 1984.
37. INEN. Centro de investigación en cáncer "Maes Heller". Registro de cáncer en Lima metropolitana. 1990-1991. Lima, abril 1995.
38. Goldman Harvey. Gastritis. In Pathology of the Gastrointestinal Tract. Second edition. Si-Chun Ming, Harvey Goldman Editors. Williams and Wilkins. 23:525-557, 1998.
39. Spechler Stuart Jon. Esophageal and esophagogastric junction adenocarcinoma. In Barrett´s Esophagus. Editors: Prateek Sharma and Richard E. Sampliner. Blacwell Science. 19: 198-207, 2001.
40. Hamilton Stanley R. . Esophagitis. In Pathology of the Gastrointestinal Tract. Second edition. Siu-Chun Ming, Harvey Goldman Editors. Williams and Wilkins. 20:433-474, 1998.
41. Piscoya A, Bussalleu A, Cok J, Combe J. Comparación de los hallazgos histopatológicos entre las biopsias de la mucosa gástrica no neoplásica de pacientes con cáncer gástrico y las biopsias de la mucosa gástrica de pacientes dispépticos sin cáncer gástrico. Rev. Gastroent. Perú 21:107-114, 2001.
42. Gilman RH, León-Barúa R, Ramirez Ramos A, Recavarren-Arce S, Spira W. Significance of Campilobacter pylori. P,39. Proceedings of the second Tokyo International Symposium on Campilobacter pylori, Tokyo, 1989.
43. Klein PD, et al. The Gastrointestinal Physiology Working Group of Cayetano Heredia and The Johns Hopkins Universities. Water source as risk factor for HP infection in Peruvian children. Lancet 337:1503-1506, 1991.
44. Recavarren-Arce S, León-Barúa R, Cok J, Berendson R, Gilman RH. Helicobacter pylori and progressive pathology that predisposes to gastric cancer. Scandinavian Journal of Gastroenterology 26(Suppl. 181):51-57,1991.
45. León-Barúa R, Recavarren-Arce S, Gilman RH, Berendson R. Can eradication of Helicobacter pylori prevent gastric cancer? Drugs 46(3):341-346, 1993.
46. León-Barúa R, Recavarren-Arce S, Berendson R, Gilman R. Helicobacter pylori y cáncer gástrico. Rev. Gastroent. Perú. 15-S(1): S23-S27, 1995.